 Friedrich Kekule (1829–1896) berhasil mengungkapkan
bagaimana enam atom karbon pada molekul benzena berikatan dengan atom hidrogen.
Dia bermimpi tentang barisan atom-atom karbon dan hidrogen membentuk cincin,
seperti seekor ular yang menelan ekornya sendiri. Pada 1872, Kekule mengusulkan
perubahan struktur benzena. Menurut Kekule, benzena mengandung tiga ikatan
tunggal dan tiga ikatan rangkap yang posisinya berselang-seling.
Friedrich Kekule (1829–1896) berhasil mengungkapkan
bagaimana enam atom karbon pada molekul benzena berikatan dengan atom hidrogen.
Dia bermimpi tentang barisan atom-atom karbon dan hidrogen membentuk cincin,
seperti seekor ular yang menelan ekornya sendiri. Pada 1872, Kekule mengusulkan
perubahan struktur benzena. Menurut Kekule, benzena mengandung tiga ikatan
tunggal dan tiga ikatan rangkap yang posisinya berselang-seling.
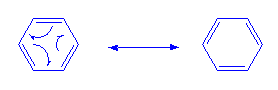
Tiap atom C pada benzena memiliki satu elektron bebas
yang berada pada orbital p yang satu sama lain sama jauhnya. Akibatnya elektron
tersebut terdelokalisasi seputar cincin. Inilah yang menjadi ciri khas senyawa
aromatik.
enam bersifat aromatik jika:
·
semua atom penyusunnya terletak dalam bidang
datar (planar)
·
setiap atom yang membentuk cincin memiliki satu
orbital 2p
·
memiliki elektron pi dalam susunan siklik dari
orbital-orbital 2p sebanyak 4n+2
(n= 0, 1, 2, 3, …)
Sumber:
Michael Purba. 2000. Kimia 2000 3B Tengah Tahun Kedua – SMU Kelas 3. Jakarta: Erlangga.

Tidak ada komentar:
Posting Komentar